巨噬细胞是免疫系统中的重要细胞类型,也是单核吞噬系统的重要组成部分,参与免疫系统调节、病原体清除、伤口愈合和血管生成等。临床前研究表明,骨髓来源的巨噬细胞(Bone Marrow Derived Macrophage,BMDM)的注射能够减轻炎症、消除纤维化并促进肝组织再生[1,2],而今年在Nature Medicine发表的研究成果“Autologous macrophage therapy for liver cirrhosis: a phase 2 open-label randomized controlled trial”也进一步表明巨噬细胞可以通过释放抗纤维因子和促进肝细胞再生来进行肝硬化治疗,拥有显著的治疗优势[3]。
在体外培养过程中,巨噬细胞具有高度的可塑性,能够根据微环境的不同极化为不同的表型。在各种细胞因子的刺激下,未分化的巨噬细胞(M0)主要极化为两种表型:M1型(促炎,经典活化)和M2型(抑炎,替代活化)。
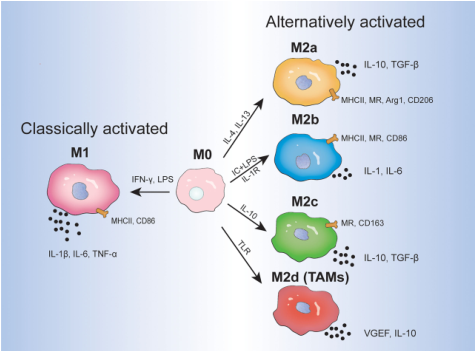
图1 不同刺激下的巨噬细胞表型[4]
BMDM培养实验步骤[5-7]
小鼠骨髓细胞提取
01 小鼠(6~8周)颈椎脱臼法处死,将处死的小鼠迅速放入含有75%酒精的小烧杯中浸泡2min。
注:BMDM受污染后,培养时会变得不粘附,因此暴露骨髓前应确保乙醇彻底浸泡小鼠
02 在超净台中,手术取出所有的胫骨和股骨,并用剪刀和镊子将骨周围的肌肉组织尽量去除干净;
注:BMDM接种培养后汇合度能达到75%,如果细胞较稀少,可能是由于切割股骨和胫骨边缘过多导致收集的骨髓量不足,每次应切割骨边缘0.5毫米,以减少损失。
03 将取好的骨头转移到装有无菌PBS的培养皿中,涮洗一次后转移至另一个装有无菌PBS的培养皿;
04 用剪刀剪去骨的两端,再用注射器抽取PBS,针头分别插入两端骨髓腔中,用注射器打入PBS,反复冲洗骨髓至培养皿中,直至骨头完全变白;
注:分离过程应全程在冰上操作,保持低温环境
05 收集骨髓悬液,用70um筛网过滤去除小碎片和肌肉组织;将滤过液500g,5 min离心,弃去上清;
06 将离心后的沉淀吹散,用ACK缓冲液去除红细胞,200g、5min离心,弃去上清。
07 将细胞以5×105个cells/mL接种在含有10%FBS、1%青霉素-链霉素和10ng/mL M-CSF(Cat#CB34)的DMEM培养基中进行培养。
巨噬细胞极化诱导
隔天半量换液,给细胞补充新鲜的含细胞因子M-CSF的培养基。诱导分化6-7天,细胞分化成M0。
注:大概3天后,骨髓细胞培养物开始呈现良好状态,形成了分裂细胞簇,此时已经可以观察到最初的贴壁细胞
M1方向极化
分化6-7天后,在Mouse M-CSF存在的情况下,继续加入100ng/ml的LPS和50ng/ml的Mouse IFN-γ(Cat#C746),极化24-48小时;
M2方向极化
分化6-7天后,在Mouse M-CSF存在的情况下,继续加入10ng/ml的Mouse IL-4(Cat#CK15)和(或)10ng/ml的Mouse IL-13(Cat#CX57),极化24-48小时。
巨噬细胞鉴定
M0型:流式检测,选择F4/80+和CD11b+双阳表达作为鉴定巨噬细胞成熟的标志蛋白;
M1型:流式检测,M1巨噬细胞上调表达CD86、MHCⅡ、CD11c等;
M2型:流式检测,M2巨噬细胞上调表达CD20等;
近岸蛋白可提供科研级M-CSF、IFN gamma、IL-4、IL-10、IL-13等细胞因子产品,高活性、低内毒素、高批间一致性,助力体外巨噬细胞培养。
产品验证数据
Recombinant Mouse M-CSF (167篇文献引用)
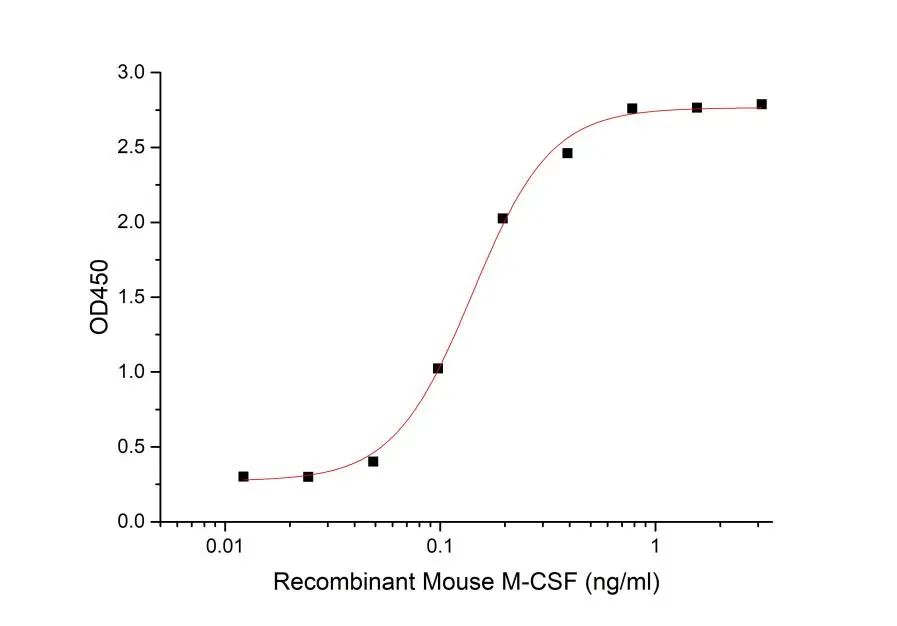
Measured in a cell proliferation assay using M‑NFS‑60 mouse myelogenous leukemia lymphoblast cells.The ED50 for this effect is 0.04-0.2 ng/ml.
Recombinant Mouse IFN gamma
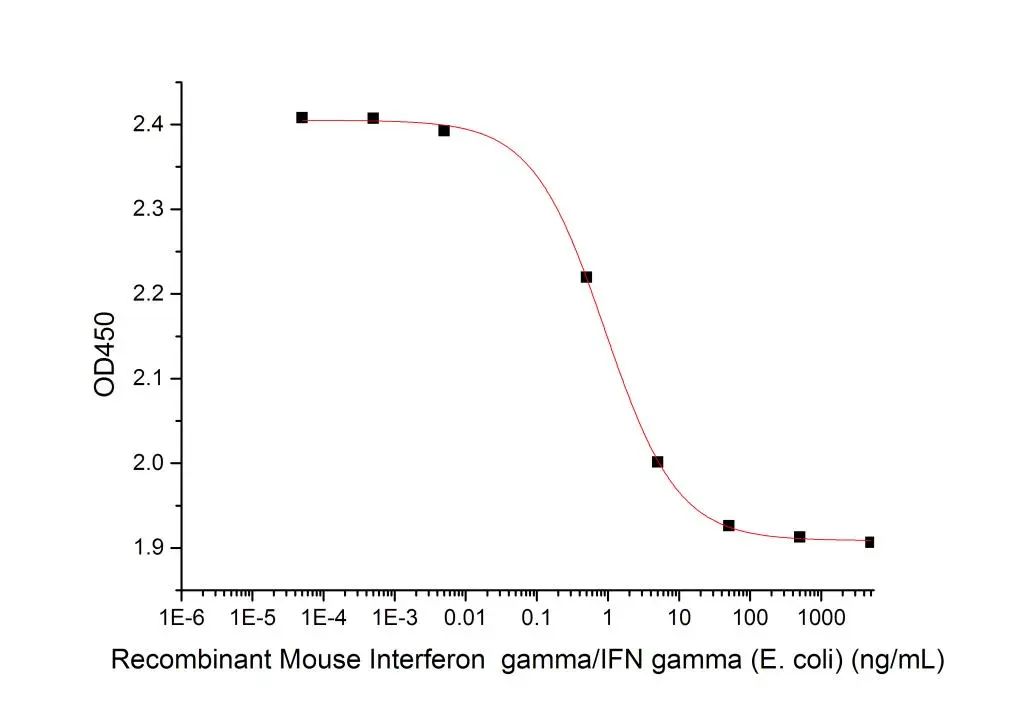
Determined by its ability to inhibit the proliferation of murine WEHI-279 cells. The expected ED50 is 1 ng/ml.
Recombinant Mouse IL-4
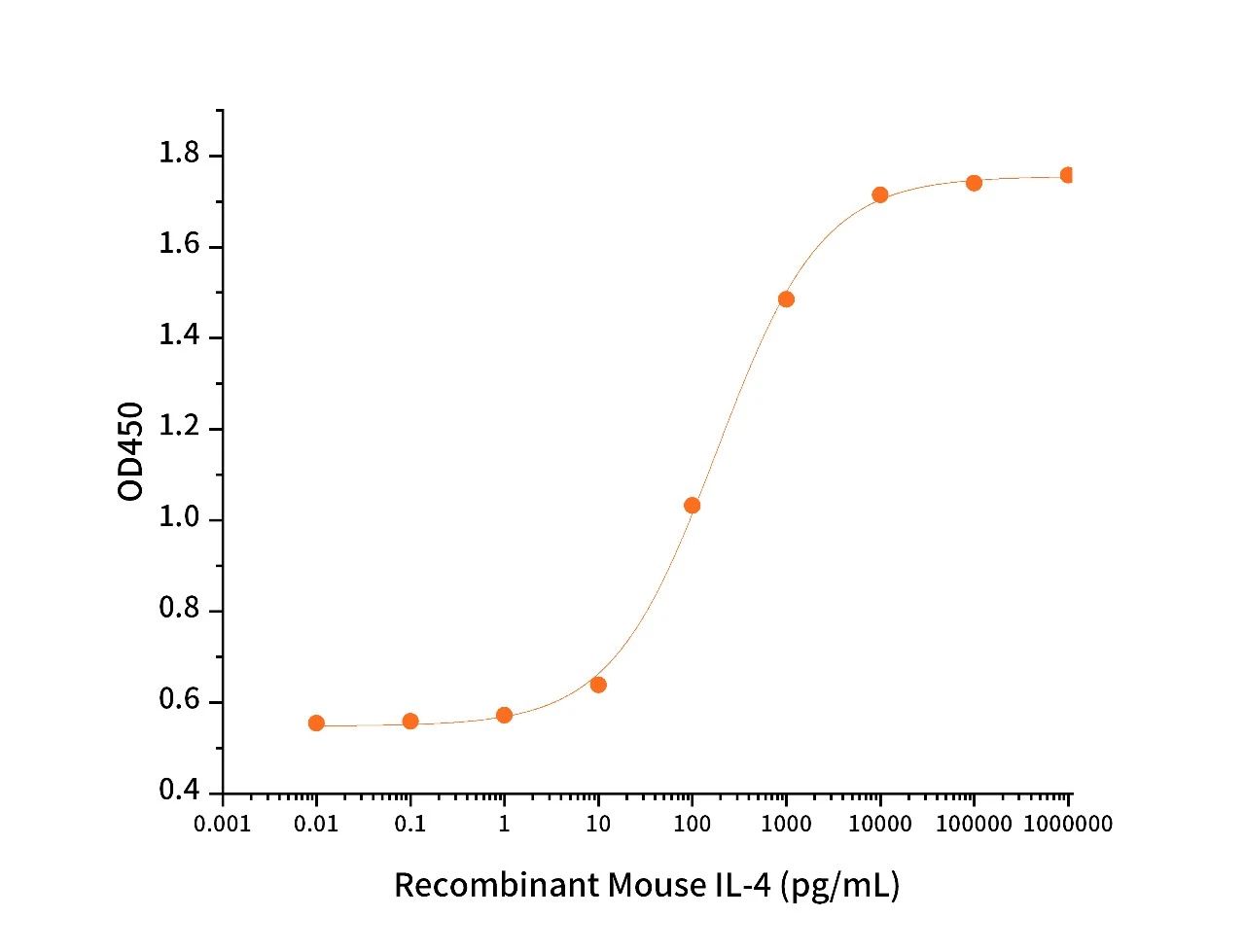
Measured in a cell proliferation assay using NFS‑60 mouse myelogenous leukemia lymphoblast cells.The ED50 for this effect is 182 pg/mL.
Recombinant Mouse IL-13
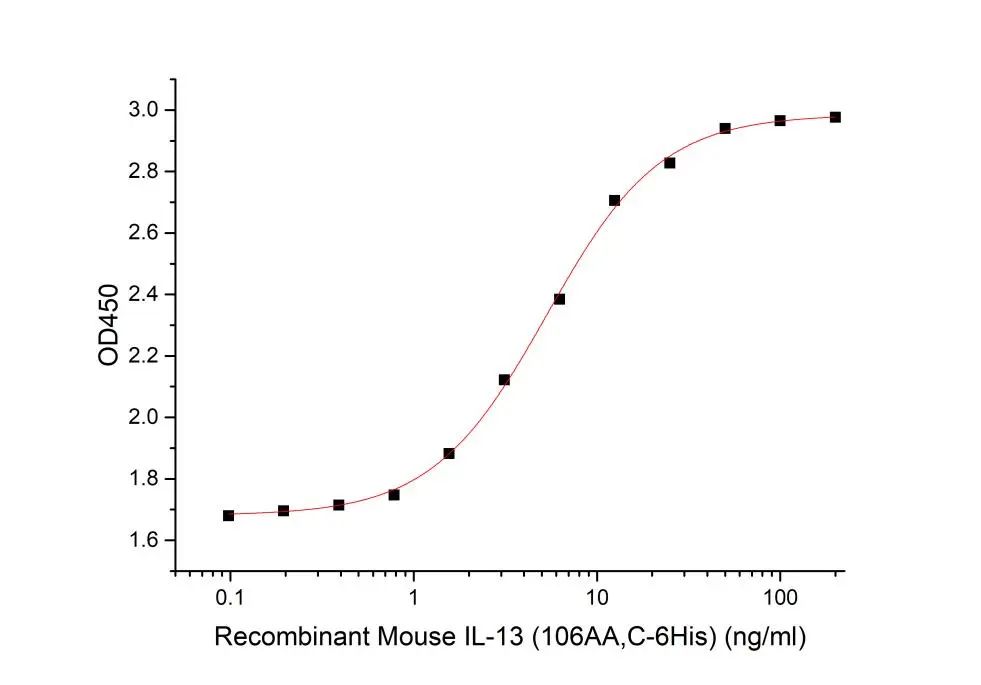
Measured in a cell proliferation assay using TF‑1 human erythroleukemic cells. The ED50 for this effect is 2-13 ng/ml.
参考文献
[1]Bird, T. G. et al. Bone marrow injection stimulates hepatic ductular reactions in the absence of injury via macrophage-mediated TWEAK signaling. Proc. Natl Acad. Sci. USA 110, 6542–6547 (2013).
[2]Thomas, J. A. et al. Macrophage therapy for murine liver fibrosis recruits host effector cells improving fibrosis, regeneration, and function. Hepatology 53, 2003–2015 (2011).
[3]Brennan, Paul N et al. Autologous macrophage therapy for liver cirrhosis: a phase 2 open-label randomized controlled trial.Nature medicine vol. 31,3 (2025)
[4]Gao, Jing et al. Shaping Polarization Of Tumor-Associated Macrophages In Cancer Immunotherapy.Frontiers in immunology vol. 13 888713. 30 Jun. 2022.
[5]Song, Jin-Qian et al. Discovery of Balasubramide Derivative with Tissue-Specific Anti-Inflammatory Activity Against Acute Lung Injury by Targeting VDAC1.”Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 11,48 (2024)
[6]Ying W, Cheruku PS, Bazer FW, Safe SH, Zhou B. Investigation of macrophage polarization using bone marrow derived macrophages. J Vis Exp. 2013
[7]Delprat V, Tellier C, Demazy C, Raes M, Feron O, Michiels C. Cycling hypoxia promotes a pro-inflammatory phenotype in macrophages via JNK/p65 signaling pathway. Sci Rep. 2020
